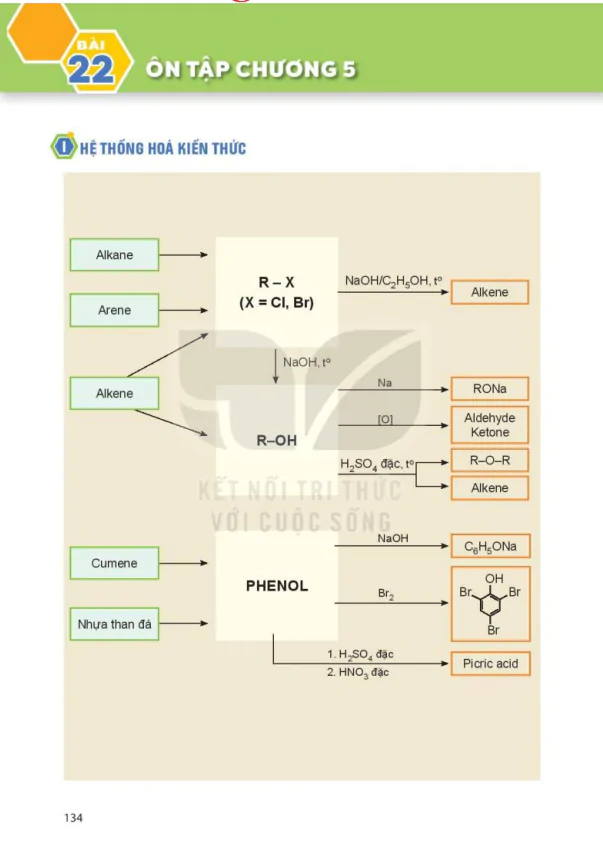
Nội Dung Chính
(Trang 129)
MỤC TIÊU
- Nêu được khái niệm về phenol, tên gọi, công thức cấu tạo một số phenol đơn giản, đặc điểm cấu tạo và hình dạng phân tử của phenol.
- Nêu được tính chất vật lí của phenol.
- Trình bày được tính chất hoá học cơ bản của phenol: phản ứng thế H ở nhóm –OH, phản ứng thế ở vòng thơm.
- Thực hiện được (hoặc quan sát video, hoặc qua mô tả: thí nghiệm của phenol với sodium hydroxide, sodium carbonate, với nước bromine) với HNO3 đặc trong H2SO4 đặc, mô tả hiện tượng thí nghiệm, giải thích được tính chất hoá học của phenol.
- Trình bày được ứng dụng của phenol và điều chế phenol (từ cumene và từ nhựa than đá).
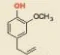
| Mở đầu Catechin là một hợp chất phenol có trong lá chè xanh. Catechin có tác dụng chống oxi hoá, diệt khuẩn, kháng viêm, ngăn ngừa một số bệnh về tim mạch, cao huyết áp, tiêu hoá, làm chậm quá trình lão hoá,... Vậy hợp chất phenol là gì và có các tính chất đặc trưng nào?
Catechin |
I. KHÁI NIỆM
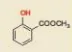
Phenol là những hợp chất hữu cơ trong phân từ có nhóm –OH liên kết trực tiếp với nguyên từ carbon của vòng benzene. zen
Hợp chất phenol đơn giản nhất có công thức là C6H5OH cũng có tên gọi riêng là phenol.
Tên thông thường của một số phenol:
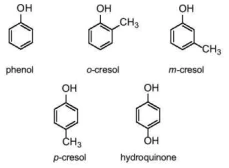
phenol
o-cresol
m-cresol
p-cresol
hydroquinon
| EM CÓ BIẾT Các hợp chất thiên nhiên chứa phenol Trong tự nhiên, các hợp chất phenol tốn tại khá phổ biến trong nhiều loài thực vật. Ví dụ:
thymol (tinh dầu xạ hương)
methyl salicylate (tinh dầu lộc để xanh)
eugenol (tinh dầu hương nhu)
vitamin E (dầu thực vật) |
(Trang 130)
I. ĐẶC ĐIỂM CẤU TẠO CỦA PHENOL
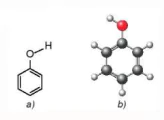
Hình 21.1. Công thức cấu tạo (a) và mô hình phân tử (b) của phenol
Trong phân từ phenol, do ảnh hưởng của vòng benzene nên liên kết O-H của phenol phân cực mạnh hơn so với alcohol, vì vậy phenol thể hiện tính acid yếu.
Ngoài ra, do có vòng benzene nên phenol có thể tham gia phản ứng thế nguyên tửhydrogen của vòng benzene.
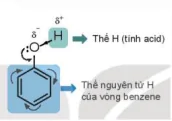
Thể H (tính acid)
Thể nguyên tử H của vòng benzene
III. TÍNH CHẤT VẬT LÍ
Ở điều kiện thường, phenol là chất rắn không màu, nóng chảy ở 43 °C, sôi ở 181,8°C.
Phenol it tan trong nước ở điều kiện thường (độ tan trong nước ở 25 °C: 8,42 g/100 g nước), tan nhiều khi đun nóng (tan vô hạn ở 66°C); tan tốt trong các dung môi hữu cơ như ethanol, ether và acetone. Phenol độc và có thể gây bỏng khi tiếp xúc với da nên phải cẩn thận khi sử dụng.
IV. TÍNH CHẤT HOÁ HỌC
1. Phản ứng thế nguyên tử H của nhóm -OH (tính acid của phenol)
Trong dung dịch nước, phenol phân li theo cân bằng sau:
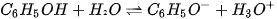
ion phenolate
Phenol là một acid yếu, dung dịch phenol không làm đồi màu quỳ tím.
Phenol có thể phản ứng được với kim loại kiềm, dung dịch base, muối sodium carbonate,...
Ví dụ:
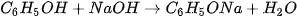
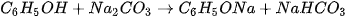
(1) Phenol có tính acid mạnh hơn nấc hai của carbonic acid (H₂CO₃) nên có thể phản ứng được với muối carbonate.
(Trang 131)
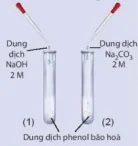
| Hoạt động nghiên cứu Nghiên cứu phản ứng của phenol với dung dịch NaOH và dung dịch Na2CO3 Thí nghiệm phenol tác dụng với dung dịch NaOH và với dung dịch Na2CO3 được tiến hành như sau: - Cho vào hai ống nghiệm, mỗi ống nghiệm khoảng 1 mL dung dịch phenol bão hoà (có màu trắng đục). - Cho khoảng 1 mL dung dịch NaOH 2 M vào ống nghiệm (1) và lắc đều. -Cho khoảng 1 mL dung dịch Na2CO3 2 M vào ống nghiệm (2) và lắc đều. Cả hai ống nghiệm đều quan sát được dung dịch từ màu trắng đục chuyển sang trong suốt. Hãy giải thích các hiện tượng xảy ra.
Hình 21.2. Thí nghiệm phán ùng của phenol với dung dịch NaOH và dung dịch Na2CO3 Dung dịch NaOH 2 M Dung dịch Na₂CO₃ 2 M Dung dịch phenol bão hoà |
| CÂU HỎI VÀ BÀI TẬP 1. Hãy giải thích tại sao phenol có thể phản ứng được với dung dịch NaOH còn alcohol thì không phản ứng với dung dịch NaOH. |
2. Phản ứng thế ở vòng thơm
Phenol có thể tham gia phản ứng thế nguyên từ hydrogen của vòng benzene. Phản ứng thể ưu tiên vào vị trí 2, 4 và 6 (ortho và para).
a) Phản ứng bromine hoá
Phenol phản ứng với nước bromine tạo sản phẩm thể 2,4,6-tribromophenol ở dạng kết tủa màu trắng.
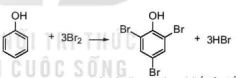
2,4,6-tribromophenol (kết tủa trắng)
Do ảnh hưởng của nhóm –OH, phản ứng thế nguyên tử hydrogen ở vòng benzene của phenol xảy ra dễ dàng hơn so với benzene.
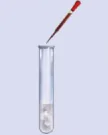
| Hoạt động nghiên cứu Phản ứng của phenol với nước bromine Phản ứng của phenol với nước bromine được tiến hành như sau: - Cho khoảng 1,0 mL dung dịch phenol 5% vào ống nghiệm. - Nhỏ vài giọt nước bromine bão hoà vào ống nghiệm, lắc đều. Nước bromine mất màu và xuất hiện kết tủa trắng. Hãy giải thích hiện tượng xảy ra và viết phương trình hoá học của phản ứng.
Hình 21.3. Phenol phản ứng với nước bromine |
(Trang 132)
| CÂU HỎI VÀ BÀI TẬP 2. So sánh điều kiện phản ứng bromine hoà vào vòng benzene của phenol và benzene. Từ đó, rút ra nhận xét khả năng thế nguyên từ hydrogen ở vòng benzene của phenol so với benzene. 3. Viết phương trình hoá học của phản ứng xảy ra khi cho 4-methylphenol tác dụng với nước bromine. |
b) Phản ứng nitro hoá
Phenol phản ứng với dung dịch nitric acid đặc trong dung dịch sulfuric acid đặc tạo thành sản phẩm 2,4,6-trinitrophenol (picric acid):
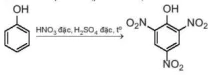
2,4,6-trinitrophenol
| Hoạt động nghiên cứu Nghiên cứu phản ứng nitro hoá phenol – tổng hợp picric acid Thí nghiệm nitro hoá phenol được tiến hành như sau: - Cho 0,5 g phenol và khoảng 1,5 mL H2SO4 đặc vào ống nghiệm, đun nhẹ hỗn hợp trong khoảng 10 phút để thu được chất lỏng đồng nhất. - Để nguội ống nghiệm rồi ngâm bình trong cốc nước đá. - Nhỏ từ từ 3 mL dung dịch HNO3 đặc vào hỗn hợp và lắc đều. Nút bằng bông tầm dung dịch NaOH. - Đun cách thuỷ hỗn hợp trong nồi nước nóng 15 phút. - Làm lạnh hỗn hợp rồi đem pha loãng hỗn hợp với khoảng 10 mL nước cất, picric acid kết tủa ở dạng tinh thể màu vàng. Hãy giải thích hiện tượng xảy ra và viết phương trình hoá học của phản ứng. Chú ý: Thí nghiệm thực hiện trong tủ hốt hoặc nơi thoáng khí. Cần thận trọng khi làm việc với dung dịch HNO3 đặc và dung dịch H2SO4 đặc. |
V. ỨNG DỤNG
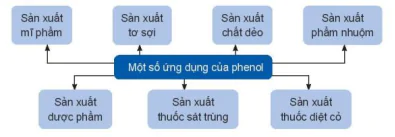
Một số ứng dụng của phenol
Sản xuất mĩ phẩm
Sản xuất tơ sợi
Sản xuất chất dẻo
Sản xuất phẩm nhuộm
Sản xuất dược phẩm
Sản xuất thuốc sát trùng
Sản xuất thuốc diệt cỏ
(Trang 133)
| EM CÓ BIẾT Phenol được sử dụng chủ yếu làm nguyên liệu để tổng hợp các vật liệu nhựa, chất dẻo, tơ sợi. Từ phenol tổng hợp bisphenol A để sản xuất nhựa polycarbonate; tổng hợp cyclohexanol để sản xuất nylon-6,6; nhựa phenolformaldehyde;... |
VI. ĐIỀU CHẾ
Phenol được tổng hợp từ cumene (isopropylbenzene) bằng phản ứng oxi hoá bởi oxygen rồi thuỷ phân trong môi trường acid thu được hai sản phầm là phenol và acetone:
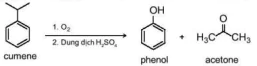
1. O2SO
2. Dung dịch H2SO4
cumene
phenol
acetone
Hiện nay, phần lớn phenol và acetone đều được sản xuất trong công nghiệp theo phương pháp này.
Ngoài ra, phenol còn được điều chế từ nhựa than đá.
| Hoạt động nghiên cứu Sưu tầm, tìm hiểu thông tin và trình bày một số ứng dụng của phenol trong đời sống và trong sản xuất. |
| EM ĐÃ HỌC
- Phenol có tính acid yếu. - Phản ứng thể ở vòng benzene.
|
| EM CÓ THỂ
|








































































Bình Luận
Để Lại Bình Luận Của Bạn