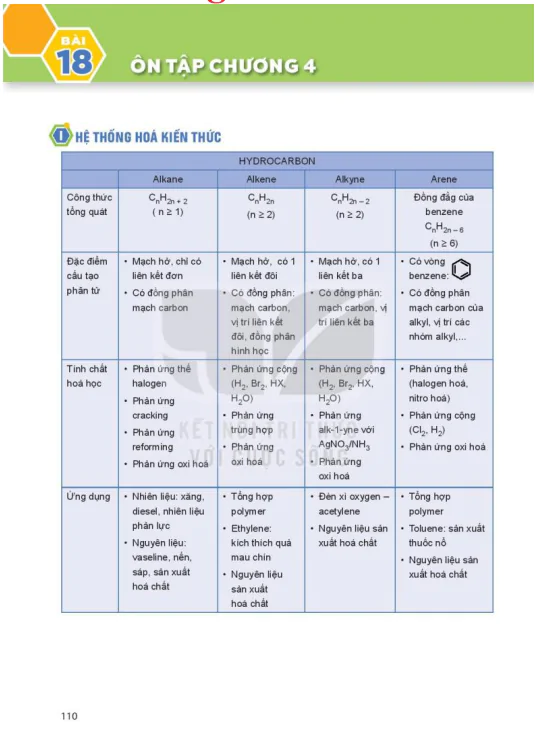
Nội Dung Chính
(Trang 92)
MỤC TIÊU
- Nêu được khái niệm về alkene và alkyne, công thức chung của alkene, đặc điểm liên kết, hình dạng phân tử của ethylene và acetylene.
- Gọi được tên một số alkene, alkyne đơn giản (C2-C5), tên thông thường một vài alkene, alkyne thường gặp.
- Nêu được khái niệm và xác định được đồng phân hình học (cis-, trans-) trong một số trường hợp đơn giản.
- Nêu được đặc điểm về tính chất vật lí của một số alkene, alkyne.
- Trình bày được các tính chất hoá học của alkene, alkyne: phản ứng cộng hydrogen, cộng halogen (bromine); cộng hydrogen halide (HBr) và cộng nước; quy tắc Markovnikov; phản ứng trùng hợp của alkene; phản ứng của alk-1-yne với dung dịch AgNO3 trong NH3; phản ứng oxi hoá.
- Thực hiện được thí nghiệm điều chế và thử tính chất của ethylene và acetylene; mô tả các hiện tượng thí nghiệm và giải thích được tính chất hoá học của alkene, alkyne.
- Trình bày được ứng dụng của các alkene và acetylene trong thực tiễn; phương pháp điều chế alkene, acetylene trong phòng thí nghiệm (phản ứng dehydrate hoá alcohol điều ché alkene, từ calcium carbide điều chế acetylene) và trong công nghiệp (phản ứng cracking điều chế alkene, điều chế acetylene từ methane). ra đời của hoá học alkene khoảng giữa thế kỉ XX là một dấu mốc quan trọng tạo nên bước
| Mở đầu Sự ra đời của hoá học alkene khoảng giữa thế kỉ XX là một dấu mốc quan trọng tạo nên bước đột phá cho sự phát triển mạnh mẽ của công nghiệp hoá học hữu cơ. Vậy, alkene, alkyne có vai trò quan trọng thể nào trong hoá học nói chung và hoá hữu cơ nói riêng? |
I. KHÁI NIỆM, ĐỒNG PHÂN, DANH PHÁP
1. Khái niệm và công thức chung của alkene, alkyne
| Hoạt động nghiên cứu Em hãy viết công thức electron, công thức Lewis của các hydrocarbon sau: C2H6 C2H4, C2H2 Nhận xét sự khác nhau về đặc điểm liên kết trong phân tử của ba hydrocarbon trên. |
Hydrocarbon không no là những hydrocarbon trong phân tử có chứa liên kết đôi, liên kết ba (gọi chung là liên kết bội) hoặc đồng thời cả liên kết đôi và liên kết ba.
| Hydrocarbon không no | Alkene | Alkyne |
| Khái niệm | Alkene là các hydrocarbon không no, mạch hở, có chứa một liên kết đôi 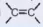 | Alkyne là các hydrocarbon không no, mạch hở có chứa một liên kết ba -C≡C- trong phân từ. |
| Công thức chung | CnH2n (n ≥2) | CnH2n-2 (n ≥2) |
| Ví dụ | C2H4, C3H6, C4H8.... | C2H2, C3H4, C4H6 |
(Trang 93)
2. Đồng phân
a) Đồng phân cấu tạo
Alkene và alkyne có hai loại đồng phân cấu tạo là đồng phân vị trí liên kết bội (từ C4 trở lên) và đồng phân mạch carbon (từ C4 trở lên với alkene và từ C5 trở lên với alkyne).
Ví dụ: alkene C4H8 có ba đồng phân cấu tạo:
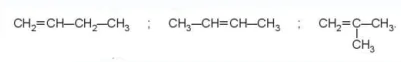
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
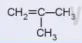
CH2=C-CH3 CH3
b) Đồng phân hình học
Trong phân tử alkene nếu mỗi nguyên tử carbon của liên kết đôi liên kết với hai nguyên tử hoặc hai nhóm nguyên tử khác nhau thì sẽ có đồng phân hình học.
Nếu mạch chính nằm ở cùng một phía của liên kết đôi, gọi là đồng phân hình học dạng cis-.
Nếu mạch chính nằm ở hai phía khác nhau của liên kết đôi, gọi là đồng phân hình học dạng trans-.
Ví dụ: phân tử but-2-ene có hai đồng phân hình học dạng cis- và dạng trans-.

cis-but-2-ene
trans-but-2-ene
| Hoạt động ghiên cứu 1. Điều kiện để có đồng phân hình học của alkene 2. Alkene |
| EM CÓ BIẾT Các hydrocarbon không no trong tự nhiên Trong tự nhiên, các hydrocarbon mạch hở và mạch vòng chứa liên kết đôi ở dạng alkadiene, alkatriene, alkapolyene, cycloalkene,... có nhiều trong tinh dầu thảo mộc. Các tinh dầu này có chứa các chất gọi là terpene. Phân tử của terpene được tạo thành từ các đơn vị mắt xích cơ bản là isoprene (2-methyl-buta-1,3-diene). Ví dụ: limonene có trong tinh dầu cam, chanh; myrcene được tìm thấy trong các thực vật có mùi thơm đậm như xoài, hoa bia, lá nguyệt quế, cỏ xạ hương, sả và húng quế; ocimene có trong lá cây húng quế, chúng có mùi thơm rất dễ chịu; a-pinene và ẞ-pinene là thành phần chính của dầu thông; ẞ-carotene có thể được tìm thấy trong các loại rau, củ màu vàng, màu da cam như khoai lang, cà rốt; lycopene là sắc tố màu đỏ tươi được tìm thấy trong nhiều loại rau quả có màu đỏ như cà chua, dưa hấu, đu đủ,...
Hình 16.1. Công thức cấu tạo của limonene và ẞ-carotene |
(Trang 94)
3. Danh pháp
Tên theo danh pháp thay thế của alkene và alkyne:

Phần nền-vị trí liên kết bội
ene hoặc yne
Lưu ý:
- Chọn mạch carbon dài nhất, có nhiều nhánh nhất và có chứa liên kết bội làm mạch chính.
- Đánh số sao cho nguyên tử carbon có liên kết bội (đôi hoặc ba) có chỉ số nhỏ nhất (đánh số mạch chính từ đầu gần liên kết bội).
- Dùng chữ số (1, 2, 3,...) và gạch nối (-) đề chỉ vị trí liên kết bội (nếu chỉ có một vị trí duy nhất của liên kết bội thì không cần).
- Nếu alkene hoặc alkyne có nhánh thì cần thêm vị trí nhảnh và tên nhánh trước tên của alkene và alkyne tương ứng với mạch chính.
Bảng 16.1. Tên gọi của của một số alkene, alkyne
| Số carbon | Công thức alkene | Tên alkene | Công thức alkyne | Tên alkyne |
| 2 | CH2=CH2 | ethene (ethylene) | 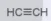 | ethyne (acetylene) |
| 3 | CH2=CH-CH3 | propene (propylene) | 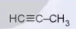 | propyne |
| 4 | CH3-CH=CH-CH3 CH3-CH=CH-CH3
| but-1-ene but-2-ene methylpropene | 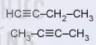 | but-1-yne but-2-yne |
| 5 | CH2=CH-CH-CH2-CH2-CH3 | pent-1-ene |  | pent-1-yne |
(Tên thông thường của một số alkene, alkyne được để trong ngoặc)
| CÂU HỎI VÀ BÀI TẬP 1. Viết các công thức cấu tạo và gọi tên theo danh pháp thay thế của các alkene và alkyne có công thức phân tử C5H10, C5H8 2. Trong các chất sau, chất nào có đồng phân hình học?
|
(Trang 95)
II. ĐẶC ĐIỂM CẤU TẠO CỦA ETHYLENE VÀ ACETYLENE
1. Etylen
Phân tử ethylene (C2H4) có 2 nguyên tử carbon và 4 nguyên tử hydrogen đều nằm trên một mặt phẳng. Liên kết đôi C=C gồm một liên kết ở và một liên kết π.
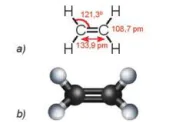
Hình 16.2. Công thức cấu tạo (a) và mô hình phân tử (b) của ethylene
2. Acetylene
Phân tử acetylene (C2H2) có 2 nguyên tử carbon và 2 nguyên tử hydrogen nằm trên một đường thẳng, góc liên kết  là 180°. Liên kết ba C≡C bao gồm một liên kết ơ và hai liên kết π.
là 180°. Liên kết ba C≡C bao gồm một liên kết ơ và hai liên kết π.
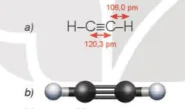
Hình 16.3. Công thức cấu tạo (a) và mô hình phân tử (b) của acetylene
III. TÍNH CHẤT VẬT LÍ
Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng của alkene, alkyne không khác nhiều với alkane tương ứng. Các alkene, alkyne là những hợp chất không có mùi và đều nhẹ hơn nước.
Ở nhiệt độ thường, phần lớn các alkene và alkyne từ C2 đến C4 ở trạng thái khí, từ C5 đến C17 ở trạng thái lòng và từ C18 trở lên ở trạng thái rắn. Chúng không tan hoặc rất ít tan trong nước, tan trong một số dung môi hữu cơ.
| EM CÓ BIẾT Ở nhiệt độ thường, độ tan của acetylene trong acetone là 2,79 gam/100 gam dung môi và trong dimethylformamide (DMF) là 5,1 gam/100 gam dung môi. Ở áp suất 20 bar, độ tan của acetylene là 68,9 gam/100 gam acetone và 62,8 gam/100 gam DMF. Vì vậy, các dung môi này được sử dụng trong các bình khí nén để lưu trữ acetylene. |
(Trang 96)
Bảng 16.2. Tính chất vật lí của một số alkene, alkyne (1)
| Alkene | Nhiệt độ nóng chảy (°C) | Nhiệt độ sôi (°C) | Khối lượng riêng (g/cm³) |
| ethene | -169 | -105 | - |
| propene | -185 | -47.8 | - |
| but-1-ene | -185 | -6,3 | - |
| trans-but-2-ene | -106 | 0.9 | - |
| cis-but-2-ene | -139 | 3.7 | - |
| pent-1-ene | -165 | 30 | 0,641 |
| Alkyne | Nhiệt độ nóng chảy (°C) | Nhiệt độ sôi (°C) | Khối lượng riêng (g/cm³) |
| ethyne | -81 | -83 | - |
| propyne | -102.7 | -23.2 | - |
| but-1-yne | -126 | 8.1 | - |
| but-2-yne | -32 | 27 | 0.691 |
| pent-1-yne | -106 | 40.2 | 0.690 |
| pent-2-yne | -109 | 56.1 | 0.711 |
IV. TÍNH CHẤT HOÁ HỌC CỦA ALKENE, ALKYNE
Các liên kết ở liên kết đôi (alkene) và liên kết ba (alkyne) kém bền vững, dễ bị đứt ra để tạo thành các liên kết mới. Vì vậy, các liên kết bội là trung tâm gây ra các phản ứng đặc trưng của hydrocarbon không no: phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hoá.
1. Phản ứng cộng
a) Phản ứng cộng hydrogen
Hydrogen hoá alkene và alkyne thu được alkane tương ứng. Phản ứng thường được thực hiện dưới áp suất cao, nhiệt độ cao và có mặt các chất xúc tác kim loại như platinum, nickel và palladium.
Ví dụ: 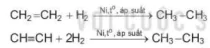
CH2=CH2 + H2 CH3-CH3
áp suất
CH=CH + 2H2 CH3-CH3
b) Phản ứng cộng halogen
Khi cho alkene hoặc alkyne phản ứng với dung dịch bromine, dung dịch sẽ bị mất màu.
Ví dụ:
CH2=CH2 + Br2 →BrCH2-CH2Br
CH=CH + 2Br2 Br2HC-CHBr2
c) Phản ứng cộng hydrogen halide
Phản ứng cộng hydrogen halide vào alkene và alkyne tạo thành halogenoalkane tương ứng.
CH2=CH2 + HBr → CH3-CH2Br
CH=CH + HBr → CH2=CHBr
CH=CH+2HBr→ CH3-CHBr2
(1) Nguồn: http://pubchem.ncbi.nlm.nih.gov.
(Trang 97)
d) Phản ứng cộng nước (hydrate hoá)
Phản ứng cộng nước vào alkene hay còn gọi là hydrate hoá alkene tạo ra alcohol.
Phản ứng thường sử dụng xúc tác phosphoric acid hoặc sulfuric acid.

Phản ứng này được thực hiện ở quy mô công nghiệp đề sản xuất ethanol.
Phản ứng cộng một phân tử HOH vào alkyne diễn ra khi có mặt của xúc tác là muối Hg(II) trong H2SO4, tạo thành aldehyde hoặc ketone.
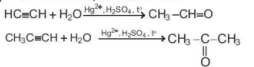
Quy tắc Markovnikov (Mác-cốp-nhi-cốp)
Phản ứng cộng một tác nhân không đối xứng HX như HBr, HCI, HI, HOH,... vào liên kết bội, nguyên tử hydrogen sẽ ưu tiên cộng vào nguyên tử carbon có nhiều hydrogen hơn và X sẽ cộng vào nguyên tử carbon có ít hydrogen hơn.
Ví dụ: 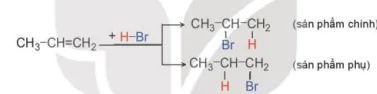
Phản ứng cộng nước vào propene với xúc tác acid được thực hiện ở quy mô công nghiệp để sản xuất isopropanol.
Phản ứng cộng acid, cộng nước vào alkyne cũng tuân theo quy tắc Markovnikov.
2. Phản ứng trùng hợp của Alkene
Phản ứng trùng họp alkene là quá trình cộng hợp liên tiếp nhiều phân từ alkene giống nhau hoặc tương tự nhau (gọi là monomer) tạo thành phân từ có phân từ khối lớn (gọi là polymer).
Ví dụ: Phản ứng trùng hợp ethylene và propylene tạo thành polyethylene (PE) và polypropylene (PP).
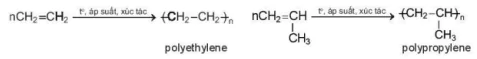
n được gọi là hệ số trùng hợp.
Phản ứng trùng hợp alkene có ứng dụng quan trọng để sản xuất vật liệu polymer.
(Trang 98)
| CÂU HỎI VÀ BÀI TẬP 3. Viết phương trình hoá học của các phản ứng: a) Propene tác dụng với hydrogen, xúc tác nickel. b) Propene tác dụng với nước, xúc tác H3PO4. c) 2-Methylpropene tác dụng với nước, xúc tác acid H3PO4 d) But-1-ene tác dụng với HCI. 4. Trong các chất sau, những chất nào làm mất màu nước bromine: propane, propene, propyne, 2-methylpropene? |
3. Phản ứng của alk-1-yne với AgNO3 trong NH3
Các alkyne có liên kết ba ở đầu mạch (alk-1-yne) có khả năng tham gia phản ứng với dung dịch AgNO3 trong NH3 tạo thành kết tủa.
Ví dụ:
HC≡CH + 2AgNO3 + 2NH3 → Ag-C=C-Ag + 2NH4NO3
(màu vàng nhạt)
4. Phản ứng oxi hoá
a) Phản ứng oxi hoá không hoàn toàn
Các alkene và alkyne có khả năng làm mất màu dung dịch thuốc tim, đây là phản ứng oxi hoá không hoàn toàn.
Ví dụ:
3CH2=CH2 + 2KMnO4 + 4H2O → 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
ethylene glycol
Phản ứng oxi hoá không hoàn toàn alkene được ứng dụng đề sản xuất các dẫn xuất chứa oxygen của hydrocarbon trong công nghiệp.
b) Phản ứng cháy
Alkene và alkyne đều dễ cháy khi có mặt oxygen, phản ứng toả nhiều nhiệt:
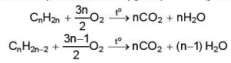
Acetylene cháy trong oxygen tạo ra ngọn lửa có nhiệt độ cao, có thể lên tới trên 3 330 °C.
| EM CÓ BIẾT Đèn xì oxygen - acetylene được ứng dụng để cắt và hàn kim loại rất phổ biến trong những thập kỉ trước. Hiện nay, do sự phát triển của công nghệ hàn hồ quang nên việc sử dụng acetylene để hàn kim loại giảm đáng kể. Tuy nhiên, thiết bị hàn oxygen - acetylene khá linh hoạt, có thể được sử dụng ở những nơi không thể tiếp cận được điện và cần nguồn nhiệt cao.
Hình 16.4. Đèn xỉ oxygen - acetylene |
(Trang 99)
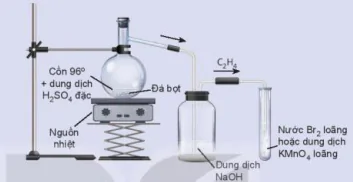
| Hoạt động thí nghiệm Thí nghiệm 1: Điều chế và thử tính chất hoá học của ethylene Chuẩn bị: cồn 96°, dung dịch sulfuric acid đặc, đá bọt; bình cầu có nhánh 250 mL, ống nghiệm (1) chứa khoảng 2 mL dung dịch KMnO4 loãng, ống nghiệm (2) chứa khoảng 2 mL nước Br2 loãng, ống dẫn thuỷ tinh hình chữ L, ống dẫn thuỷ tinh đầu vuốt nhọn, giả để ống nghiệm, nguồn nhiệt, que đóm, lưới tản nhiệt, bình thuỷ tinh chứa dung dịch NaOH.
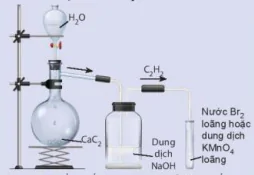
Hình 16.5. Điều chế ethylene và thử tỉnh chất Cồn 96° + dung dịch H2SO4 đặc Đá bọt C₂H₃ Nguồn nhiệt Nước Br₂ loãng hoặc dung dịch KMnO4 loãng Dung dịch NaOH Tiến hành: - Cho vài viên đá bọt, 20 mL cồn 96° vào bình cầu. Rót 40 mL dung dịch H2SO4 đặc vào ống đong, sau đó rót từ từ H₂SO₄ đặc từ ống đong qua phễu vào bình cầu để tránh sự toả nhiệt quá mạnh. - Lắp bộ dụng cụ như Hình 16.5. - Đun nóng đến khi ethylene sinh ra và sục ngay vào các ống nghiệm (1) và (2). - Thay ống dẫn khi thuỷ tinh hình chữ L bằng ống dẫn thuỷ tinh có đầu vuốt nhọn. Dùng que đóm đang cháy để đốt ethylene ở đầu ống dẫn khí. Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cần thận khi sử dụng. Hãy giải thích hiện tượng và viết phương trình hoá học của phản ứng xảy ra. Thí nghiệm 2: Điều chế và thử tính chất hoá học của acetylene Chuẩn bị: đất đèn (chứa CaC2). nước tinh khiết, ống nghiệm chứa khoảng 2 mL dung dịch KMnO4 loãng, ống nghiệm chứa khoảng 2 mL dung dịch nước Br₂ loãng, bình cầu có nhánh 250 mL, ống dẫn thuỷ tinh hình chữ L, ống dẫn thuỷ tinh đầu vuốt nhọn, giá đề ống nghiệm, que đóm, bình thuỷ tinh chứa dung dịch NaOH.
Hình 16.6. Điều chế acetylene và thử tính chất H₂O M CaC₂ Dung dịch NaOH Nước Br₂ loãng hoặc dung dịch KMnO4 loãng |
(Trang 100)
| Tiến hành: - Cho khoảng 5 g đất đèn vào bình cầu có nhánh và cho nước cất vào phễu nhỏ giọt. Lấp dụng cụ như Hình 16.6 (chú ý đuôi của phễu nhỏ giọt không chạm vào chất rắn). - Mở khoá phễu nhỏ giọt đề nước chảy từ từ xuống, khi acetylene sinh ra được sục ngay vào các ống nghiệm chứa dung dịch KMnO4 và nước Br2 đã chuẩn bị ở trên đến khi dung dịch mất màu. - Thay ống dẫn khí thuỷ tinh hình chữ L bằng ống dẫn thuỷ tinh có đầu vuốt nhọn. Dùng que đóm đang cháy để đốt acetylene sinh ra ở đầu ống dẫn khi. Hãy giải thích hiện tượng và viết phương trình hoá học của các phản ứng xảy ra. |
| CÂU HỎI VÀ BÀI TẬP 5. Hãy trình bày phương pháp hoá học nhận biết ba khi sau: ethane, ethylene, acetylene. 6. Viết phương trình hoá học của các phản ứng: a) Propene tác dụng với dung dịch KMnO4. b) Propyne tác dụng với dung dịch AgNO3/NH3. |
V. ĐIỀU CHẾ
1. ALkene
Trong phòng thí nghiệm, ethylene được điều chế từ phản ứng dehydrate ethanol:

Trong công nghiệp, alkene C2 – C4 được điều chế từ quá trình cracking alkane trong các nhà máy lọc dầu.
Các alkene này còn có thể được sản xuất từ quá trình dehydrogen xúc tác với nguyên liệu là khí dầu mỏ (ethane, propane và butane). Dehydrogen butane tạo ra butadiene và các đồng phân butene.
2. Alkyne
Acetylene được điều chế từ phản ứng giữa calcium carbide với nước:
CaC2 + 2H2O → C2H2 + Ca(OH)2
Ngoài ra, acetylene còn được điều chế bằng cách nhiệt phân methane ở nhiệt độ 1 500°C, làm lạnh nhanh để tách acetylene ra khỏi hỗn hợp với hydrogen:
2CH4 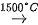 C₂H₂ + 3H₂
C₂H₂ + 3H₂
(Trang 101)
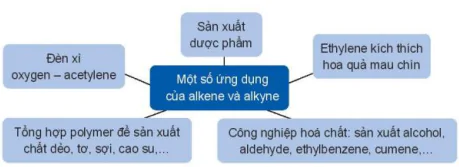
VI. ỨNG DỤNG
Một số ứng dụng của alkene và alkyne
Đèn xi oxygen - acetylene
Sản xuất dược phẩm
Ethylene kích thích hoa quả mau chín
Tổng hợp polymer đề sản xuất chất dẻo, tơ, sợi, cao su....
Công nghiệp hoá chất: sản xuất alcohol, aldehyde, ethylbenzene, cumene,...
| EM CÓ BIẾT
Ethylene và acethylene được dùng làm nguyên liệu để chuyển hoá thành các monomer như styrene, vinyl chloride, vinyl acetate, acrilonitrile,... để tổng hợp các polymer. Các alkyne là nguyên liệu sản xuất một số dược phẩm như thuốc chuối sẽ làm cà chua xanh mau chín kháng virus Efavirenz, thuốc kháng nấm Terbinafine,...
Hình 16.7. Khi ethylene sinh ra từ - chuối sẽ làm cà chua xanh mau chín |
| EM ĐÃ HỌC Công thức tổng quát của alkene: CnH2n (n ≥ 2); alkyne: CnH2n-2 (n ≥ 2). Trạng thái, nhiệt độ sôi và tính tan của một số alkene, alkyne. Alkene và alkyne có các đồng phân cấu tạo (đồng phân vị trí liên kết bội, alkene từ C4 và alkyne từ C5 có đồng phân mạch carbon); alkene từ C4 có thể đồng phân hình học. có Alkene, alkyne có thể tham gia phản ứng cộng, phản ứng oxi hoá; alk-1-yne có thể tham gia phản ứng với dung dịch AgNO3/NH3.
|
| EM CÓ THỂ Vận dụng các kiến thức về alkene, alkyne để giải thích được các vai trò quan trọng của alkene và alkyne trong công nghiệp hoá học, công nghiệp dược phẩm, vật liệu,... |
 là gì?
là gì?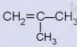 có đồng phân hình học không? Giải thích.
có đồng phân hình học không? Giải thích.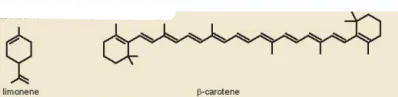











































































Bình Luận
Để Lại Bình Luận Của Bạn