Nội Dung Chính
(Trang 48)
MỤC TIÊU
- Trình bày được tính chất vật lí, cách bảo quản, sử dụng và nguyên tắc xử lí sơ bộ khi bỏng acid.
- Trình bày được cấu tạo phân tử H2SO4; tính chất vật lí, tính chất hoá học cơ bản, ứng dụng của dung dịch sulfuric acid loãng, dung dịch sulfuric acid đặc và những lưu ý khi sử dụng sulfuric acid.
- Thực hiện được một số thí nghiệm chứng minh tính oxi hoá mạnh và tính háo nước của dung dịch sulfuric acid đặc.
- Vận dụng được kiến thức về năng lượng phản ứng, chuyển dịch cân bằng, vấn đề bảo vệ môi trường để giải thích các giai đoạn trong quá trình sản xuất sulfuric acid theo phương pháp tiếp xúc.
- Nêu được ứng dụng của một số muối sulfate quan trọng: barium sulfate, ammonium sulfate, calcium sulfate, magnesium sulfate và nhận biết được ion 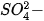
| Mở đầu Sulfuric acid là hoá chất quan trọng hàng đầu trong công nghiệp, được sử dụng cả ở dạng dung dịch loãng và dạng dung dịch đặc dựa trên những tính chất khác biệt. Vậy, dung dịch sulfuric acid loãng và dung dịch sulfuric acid đặc có những tính chất quan trọng nào? Cần lưu ý điều gì khi bảo quản và sử dụng acid này để đảm bảo an toàn? |
I. SULFURIC ACID
1. Cấu tạo phân tử
Phân tử sulfuric acid (H2SO4) có có công thức cấu tạo: 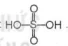
Với cấu tạo gồm các nguyên tử hydrogen linh động và các nguyên tử oxygen có độ âm điện lớn, giữa các phân từ sulfuric acid hình thành nhiều liên kết hydrogen.
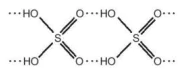
Hình 8.1. Liên kết hydrogen giữa các phân tử sulfuric acid
| CÂU HỎI VÀ BÀI TẬP 1. a) Dựa vào cấu tạo, cho biết phân tử sulfuric acid có khả năng cho bao nhiêu proton khi đóng vai trò là acid. b) Dựa vào tương tác giữa các phân tử, hãy dự đoán sulfuric acid là chất lỏng dễ bay hơi hay khó bay hơi. |
(Trang 49)
2. Tính chất vật lí
Ở điều kiện thường, sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi, có tính hút ẩm mạnh.
Dung dịch sulfuric acid 98% có khối lượng riêng 1,84 g/cm3, nặng gần gấp hai lần nước.
Sulfuric acid tan vô hạn trong nước và toà rất nhiều nhiệt. Do vậy, tuyệt đối không tự ý pha loãng sulfuric acid. Khi pha loãng dung dịch sulfuric acid đặc, để đảm bảo an toàn phải rót từ từ dung dịch sulfuric acid đặc vào nước, vừa rót vừa khuấy (không làm ngược lại).
| EM CÓ BIẾT Sulfuric acid được sử dụng làm chất hút ẩm trong các bình hút ẩm để làm khô nhiều chất. Dung dịch sulfuric acid đặc cũng được sử dụng trong các bình rửa khí để tách loại hơi nước có lẫn trong các chất khínhư chlorine, carbon dioxide, sulfur dioxide,... |
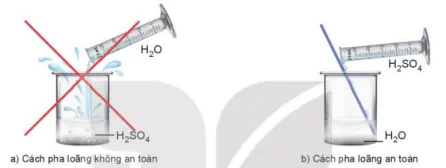
Hình 8.2. Cách pha loãng dung dịch sulfuric acid đặc
a) Cách pha loãng không an toàn
b) Cách pha loãng an toàn
3. Quy tắc an toàn
a) Bảo quản
Sulfuric acid được bảo quản trong chai, lọ có nút đậy chặt, đặt ở vị trí chắc chắn.
Đặt chai, lọ đựng dung dịch sulfuric acid đặc cách xa các lọ chứa chất dễ gây cháy, nổ như chlorate, perchlorate, permanganate, dichromate.
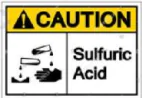
Hình 8.3. Kí hiệu cảnh báo sự nguy hiểm của sulfuric acid
b) Sử dụng
Sulfuric acid gây bỏng khi rơi vào da, do vậy khi sử dụng cần tuân thủ các nguyên tắc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm.
(2) Cầm dụng cụ chắc chắn, thao tác cần thận.
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid.
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
(5) Không được đồ nước vào dung dịch acid đặc.
(Trang 50)
c) Sơ cứu khi bỏng acid
Khi bị bỏng sulfuric acid cần thực hiện sơ cứu theo các bước sau:
1) Nhanh chóng rửa ngay với nước lạnh nhiều lần đề làm giảm lượng acid bám trên da.
Nếu bị bỏng ở vùng mặt nhưng acid chưa bắn vào mắt thì nhắm chặt mắt khi ngâm rửa. Nếu acid đã bắn vào mắt thì úp mặt vào chậu nước sạch, mở mắt và chớp nhiều lần đề rửa acid.
(2) Sau khi ngâm rửa bằng nước, cần tiến hành trung hoà acid bằng dung dịch NaHCO3 loãng (khoảng 2%).
(3) Băng bó tạm thời vết bỏng bằng băng sạch, cho người bị bỏng uống bù nước điện giải rồi đưa đến cơ sở y tế gần nhất.
| CÂU HỎI VÀ BÀI TẬP 2. a) Nêu các lưu ý bắt buộc đề đảm bảo an toàn khi sử dụng dung dịch sulfuric acid đặc. b) Hãy cho biết ý nghĩa của kí hiệu cảnh báo ở Hình 8.3. |
4. Tính chất hoá học
a) Dung dịch sulfuric acid loãng
Dung dịch sulfuric acid loãng có đầy đủ tính chất của một acid mạnh.
| Hoạt động thí nghiệm 1. Em hãy cho biết các tính chất hoá học cơ bản của một acid. 2. Viết phương trình hoá học minh hoạ tính acid của dung dịch H2SO4 loãng với: kim loại Fe, bột MgO, dung dịch Na2CO3, dung dịch BaCl2. |
| EM CÓ BIẾT Dung dịch sulfuric acid loãng được sử dụng phổ biến để tạo môi trường acid cho nhiều phản ứng trong công nghiệp và nghiên cứu. - Sản xuất copper (II) sulfate: 2Cu + O2 +2H2SO4 → 2CuSO4 + 2H2O - Chuẩn độ permanganate: 5H2C2O4 + KMnO4 → 10CO2 + K2SO4 + 2MnSO4 +8H2O - Sản xuất acquy chì: Pb + PbO2 + H2SO4 → 2PbSO4 + 2H2O |
b) Dung dịch sulfuric acid đặc
- Tính acid
Dung dịch sulfuric acid đặc có tính acid mạnh và khó bay hơi, được sử dụng đề điều chế một số acid dễ bay hơi.
Trong công nghiệp, hydrogen fluoride được điều chế từ quặng fluorite theo phản ứng:
CaF2 + H2SO4 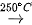
(Trang 51)
- Tính oxi hoá
| Hoạt động thí nghiệm Thí nghiệm: Đồng (copper) tác dụng với dung dịch sulfuric acid đặc, nóng Chuẩn bị: đồng lá hoặc phoi bào, dung dịch sulfuric acid 70%; ống nghiệm, kẹp gỗ, đèn cồn, bông tầm dung dịch NaOH loãng. Tiến hành: - Cho vài lá đồng đã cắt nhỏ vào ống nghiệm, thêm tiếp khoảng 3 mL dung dịch H2SO4 70%, dùng bông đã tầm dung dịch NaOH loãng nút miệng ống nghiệm. - Hơ nóng đều phần ống nghiệm chứa dung dịch trên ngọn lửa đèn cồn, sau đó đun tập trung vào đáy ống nghiệm. Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cẩn thận khi sử dụng. Quan sát, mô tả hiện tượng xảy ra và thực hiện yêu cầu sau: 1. Viết phương trình hoá học của phản ứng và xác định chất oxi hoá, chất khử. 2. Nhận xét về khả năng phản ứng của dung dịch sulfuric acid đặc, nóng với copper. |
Dung dịch sulfuric acid đặc thể hiện tính oxi hoá mạnh, nhất là khi đun nóng, kèm theo sự giảm số oxi hoá của nguyên từ sulfur:
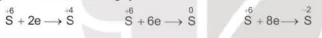
Dung dịch sulfuric acid đặc, nóng oxi hoá được nhiều kim loại, phi kim và hợp chất.
Ví dụ:
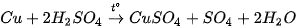
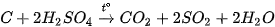
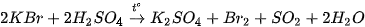
- Tính háo nước
| Hoạt động thí nghiệm Thí nghiệm: Dung dịch sulfuric acid đặc tác dụng với đường mía Chuẩn bị: đường mía (C12H22O11), dung dịch sulfuric acid đặc; cốc thuỷ tinh loại 100 mL. Tiến hành: - Lấy khoảng 10 g đường mía cho vào cốc. - Nhỏ đều trên bề mặt đường mía khoảng 2 mL dung dịch sulfuric acid đặc. Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cần thận khi sửdụng. Quan sát, mô tả hiện tượng xảy ra và thực hiện yêu cầu sau: 1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm. 2. Dự đoán hiện tượng khi cho dung dịch sulfuric acid đặc tiếp xúc với các carbohydrate khác như cellulose (giấy, bông), tinh bột (gạo). |
(Trang 52)
Dung dịch sulfuric acid đặc có khả năng lấy nước từ hợp chất carbohydrate và khiến chúng hoá đen (hiện tượng than hoá).
| CÂU HỎI VÀ BÀI TẬP 3. a) Viết phương trình hoá học của phản ứng khi cho lần lượt các chất rắn sodium chloride (NaCl), sodium bromide (NaBr) tác dụng với dung dịch sulfuric acid đặc. b) Chỉ ra vai trò của sulfuric acid trong mỗi phản ứng đó. |
5. Ứng dụng
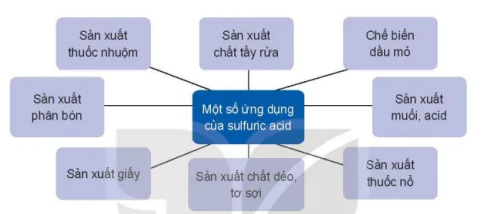
Một số ứng dụng của sulfuric acid
Sản xuất thuốc nhuộm
Sản xuất chất tẩy rửa
Chế biến dầu mỏ
Sản xuất phân bón
Sản xuất muối, acid
Sản xuất giấy
Sản xuất chất dẻo, tơ sợi
Sản xuất thuốc nổ
| Hoạt động nghiên cứu Sưu tầm tài liệu và trình bày về các ứng dụng của sulfuric acid trong các ngành sản xuất và đời sống. Vi sao sulfuric acid là hoá chất có tầm quan trọng bậc nhất? |
| CÂU HỎI VÀ BÀI TẬP 4. Dung dịch sulfuric acid đặc được sử dụng để sản xuất phosphoric acid và phân bón superphosphate từ quặng phosphorite và apatite. Hãy viết phương trình hoá học của phản ứng giữa dung dịch sulfuric acid đặc với Ca3(PO4)2 trong hai quặng trên. |
6. Sản xuất
Trong công nghiệp, sulfuric acid chủ yếu được sản xuất bằng phương pháp tiếp xúc, đi từ nguyên liệu chính là sulfur, quặng pyrite (chứa FeS2).
Phương pháp tiếp xúc gồm ba giai đoạn chính.
- Giai đoạn 1: Sản xuất sulfur dioxide
Tuỳ thuộc vào nguồn nguyên liệu, sulfur dioxide được sản xuất bằng cách đốt cháy sulfur, pyrite hoặc quặng sulfide trong lò đốt bằng không khí.
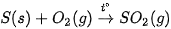
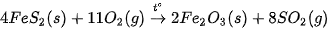
(Trang 53)
- Giai đoạn 2: Sản xuất sulfur trioxide
Oxi hoá sulfur dioxide bằng không khí dư ở nhiệt độ khoảng 450 °C, áp suất 1 - 2 bar, xúc tác vanadium (V) oxide (V2O3), hiệu suất đạt trên 98%:
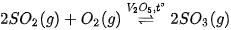
- Giai đoạn 3: Hấp thụ sulfur trioxide bằng sulfuric acid đặc, tạo ra oleum (hỗn hợp các acid có công thức chung dạng H₂SO₄nSO3). Sau đó, pha loãng oleum vào nước thu được dung dịch sulfuric acid loãng.
II. MUỐI SULFATE
1. Ứng dụng
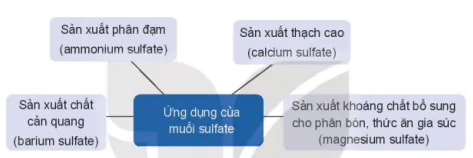
| Hoạt động nghiên cứu Tìm hiểu thêm và trình bày về các ứng dụng của muối sulfate mà em biết. |
2. Nhận biết
| Hoạt động nghiên cứu Thí nghiệm: Nhận biết ion Chuẩn bị: dung dịch Na2SO4, dung dịch BaCl2; ống nghiệm, kẹp gỗ. Tiến hành: - Lấy khoảng 1 mL dung dịch Na2SO4 cho vào ống nghiệm. - Nhỏ vài giọt dung dịch BaCl2 vào ống nghiệm, lắc nhẹ. Quan sát hiện tượng xảy ra và thực hiện các yêu cầu: 1. Viết phương trình hoá học dạng phân tử và ion rút gọn. 2. Dự đoán hiện tượng khi nhỏ dung dịch BaCl2 vào ống nghiệm đựng dung dịch H2SO4 loãng.
Hình 8.6. Phản ứng giữa Na2SO4 và BaCl2 |
(Trang 54)
| CÂU HỎI VÀ BÀI TẬP 5. Trình bày phương pháp hoá học đề phân biệt các cặp dung dịch sau: a) BaCl2 và NaCl; b) H2SO4 loãng và HCI. |
| EM ĐÃ HỌC
|
| EM CÓ THỂ Bảo quản và sử dụng sulfuric acid an toàn, biết cách sơ cứu các trường hợp bỏng acid. |
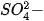










































































Bình Luận
Để Lại Bình Luận Của Bạn