Nội Dung Chính
(Trang 16)
MỤC TIÊU:
- Nêu được khái niệm sự điện li, chất điện li, chất không điện li.
- Trình bày được thuyết Brønsted - Lowry về acid - base.
- Nêu được khái niệm và ý nghĩa của pH trong thực tiễn.
- Viết được biểu thức tính pH và biết cách sử dụng các chất chỉ thị để xác định pH bằng các chất chỉ thị phổ biến như giấy chỉ thị màu, quỳ tím, phenolphthalein,...
- Nêu được nguyên tắc xác định nồng độ acid, base mạnh bằng phương pháp chuẩn độ.
- Thực hiện được thí nghiệm chuẩn độ acid - base: Chuẩn độ dung dịch base mạnh (sodium hydroxide) bằng acid mạnh (hydrochloric acid).
- Trình bày được ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+ và CO.
| Mở đầu: Hình 2.1 cho thấy giá trị pH của dung dịch một số chất thông dụng. Vậy pH là gì? pH có ảnh hưởng gì đến đời sống? Xác định pH như thế nào?
Hình 2.1. Giá trị pH của một số dung dịch 1 Dịch dạ dày 2 Nước chanh ép 3 Rượu vang 4 Nước chuối ép 5 Cà phê đen 6 Sữa 7 Nước 8 Nước biển 9 Lòng trắng trứng 10 Chất tẩy rửa đa năng 11 Nước ammonia 12 Xà phòng 13 Nước làm sạch lò nướng 14 Chất thông cống |
I. SỰ ĐIỆN LI
1. Hiện tượng điện li
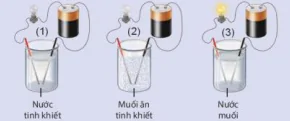
| Hoạt động nghiên cứu: Tìm hiểu về sự điện li Thí nghiệm thử tính dẫn điện của nước, muối ăn và dung dịch muối ăn được thực hiện như mô tả trong Hình 2.2.
Hình 2.2. Thử tỉnh dẫn điện của dung dịch muối ăn Nước tinh khiết Muối ăn tinh khiết Nước muối |
(Trang 17)
| Thực hiện yêu cầu: a) Hãy nhắc lại khái niệm dòng điện. b) Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ trong dung dịch có hạt mang điện. Đó có thể là loạt hạt nào (electron, phân tử NaCl, cation hay anion)? c) Hãy giải thích sự tạo thành hạt mang điện đó. |
Quá trình phân li các chất trong nước tạo thành ion được gọi là sự điện li. Những chất khi tan trong nước phân li ra các ion được gọi là chất điện li.
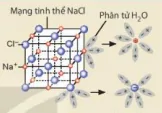
| EM CÓ BIẾT Sự phân li của NaCl trong nước NaCl là hợp chất ion, trong tình thế có các ion Na+ và CI- liên kết với nhau bằng lực hút tĩnh điện. Nước là một dung môi phân cực. Khi cho tinh thể NaCl vào nước, các ion Na+ và CI- trên bề mặt hút các phân tửnước lại gần. Các phân tử nước hưởng các đầu âm vào ion Na+, các đầu dương vào ion Cl- và làm yếu liên kết giữa các cation, anion trong tinh thế và khuếch tán vào nước (Hình 2.3). Quá trình trên được biểu diễn một cách đơn giản bằng phương trình điện li: NaCl(aq) → Na+(aq) + Cl-(aq).
Hình 2.3. Mô hình biểu diễn sự phân li của NaCl trong nước |
2. Chất điện li
a) Chất điện li và chất không điện li
| Hoạt động thí nghiệm Tìm hiểu về chất điện li và chất không điện li Kết quả thử tính dẫn điện với các dung dịch hydrochloric acid (HCI), sodium hydroxide (NaOH), saccharose (C12H22O11), ethanol (C2H5OH) được trình bày trong bảng dưới đây. Hãy hoàn thành các thông tin còn thiếu trong bảng vào vở:
|
Thí nghiệm trên cho thấy: các chất như hydrochloric acid, sodium hydroxide.... tan trong nước phân li ra các ion nên chúng là chất điện li. Saccarose, ethanol,... không phân li ra các ion nên chúng là chất không điện li.
(Trang 18)
Sự phân li một chất thành các ion mang điện trái dấu trong dung dịch được biểu diễn bằng phương trình điện li.
Ví dụ: NaOH(aq) → Na+(aq) + OH-(aq) ; HCl(aq)- → H+(aq) + Cl-(aq).
b) Chất điện li mạnh và chất điện li yếu
| Hoạt động nghiên cứu So sánh khả năng phân li trong nước của HCI và CH3COOH Kết quả thử tình dẫn điện với dung dịch HCl 0,1 M và dung dịch CH3COOH 0,1 M cho thấy trường hợp cốc đựng dung dịch HCI 0,1 M bóng đèn sáng hơn. Thực hiện yêu cầu sau: Hãy so sánh số ion mang điện trong hai dung dịch trên, từ đó cho biết acid nào phân li mạnh hơn. |
Dựa vào mức độ phân li thành các ion, chất điện li được chia thành hai loại:
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Các chất điện li mạnh thường gặp là:
- Các acid mạnh: HCI, HNO3, H2SO4,...
- Các base mạnh: NaOH, KOH, Ca(OH)2, Ba(OH)2,...
- Hầu hết các muối.
Quá trình phân li của chất điện li mạnh xảy ra gần như hoàn toàn và được biểu diễn bằng mũi tên một chiều.
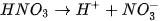
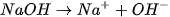
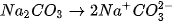
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân từ chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân từ trong dung dịch.
Ví dụ: trong dung dịch CH3COOH 0,1 M, cứ 1000 phân tử hoà tan thì chỉ có 3 phân tửphân li thành ion, còn lại tồn tại ở dạng phân tử.
Những chất điện li yếu gồm các acid yếu như CH3COOH, HCIO, HF, H2CO3... và base yếu như Cu(OH)2, Fe(OH)2....
Quá trình phân li của chất điện li yếu là một phản ứng thuận nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều nhau
CH3COOH  H+ + CH3COO-.
H+ + CH3COO-.
| CÂU HỎI VÀ BÀI TẬP 1. Viết phương trình điện li của các chất sau: HF, HI, Ba(OH)2, KNO3, Na2SO4 |
(Trang 19)
| EM CÓ BIẾT Phương trình ion rút gọn Trong dung dịch, chất điện li phân li thành các ion và chính các ion này trực tiếp tham gia vào phản ứng hoá học. Do vậy, phương trình dạng ion rút gọn được sử dụng để biểu diễn các phản ứng xảy ra giữa các chất điện li. Ví dụ 1: Khi cho dung dịch HCI (chứa ion H+ và (1) tác dụng với dung dịch NaOH (chứa ion Na+ và OH"), thực tế chỉ xảy ra phản ứng giữa ion H+ và OH theo phương trình ion rút gọn: H+ + OH- →H2O Ví dụ 2: Khi cho dung dịch BaCl, tác dụng với dung dịch Na2SO4, thực tế chỉ xảy ra phản ứng giữa ion Ba2+ và
Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li. |
II. THUYẾT ACID-BASE CỦA BRONSTED - LOWRY
1. Khái niệm acid và base theo thuyết Brønsted - Lowry
| Hoạt động nghiên cứu Cho các dung dịch: HCI, NaOH, Na2CO3. a) Viết phương trình điện li của các chất trên. b) Sử dụng máy đo pH (hoặc giấy pH) xác định pH, môi trường (acid/base) của các dung dịch trên. c) Theo khái niệm acid-base trong môn Khoa học tự nhiên ở lớp 8, trong những chất cho ở trên: Chất nào là acid? Chất nào là base? |
Khái niệm acid-base đề cập ở lớp 8 chỉ đúng với dung môi nước và chưa phản ánh đầy đủ bản chất acid/base. Năm 1923, nhà hoá học người Đan Mạch J. Brønsted (Bron-stết) và nhà hoá học người Anh T. Lowry (Lao-ri) đã đưa ra một định nghĩa tổng quát hơn về acid, base.
Thuyết Brønsted - Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton.
Ví dụ 1: 
HCl
H2O
H+
H2O
CI-
Trong phản ứng trên: HCI cho H+, HCI là acid; H2O nhận H+, H2O là base.
Ví dụ 2: 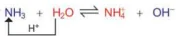
NH3
H2O
H+
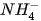
OH-
Trong phản ứng thuận, NH3 nhận H+ của H2O, NH3 là base, H2O là acid. Trong phản ứng nghịch, ion 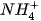 là acid, ion OH- là base.
là acid, ion OH- là base.
Ví dụ 3: 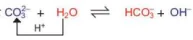
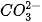
H2O
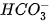
OH-
Trong phản ứng thuận, 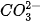 nhận H+ của H2O, CO3 là base, H2O là acid. Trong phản ứng nghịch, ion HCO3 là acid, ion OH- là base.
nhận H+ của H2O, CO3 là base, H2O là acid. Trong phản ứng nghịch, ion HCO3 là acid, ion OH- là base.
(Trang 20)
Ví dụ 4:
a) 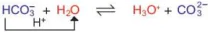
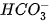
H2O
H+
H3O+
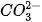
Trong phản ứng thuận, 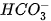
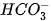 là acid, H2O là base. Trong phản ứng nghịch
là acid, H2O là base. Trong phản ứng nghịch 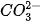 là base, H3O+ là acid.
là base, H3O+ là acid. b) 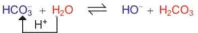
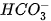
H2O
HO-
H2CO3
Trong phản ứng thuận, 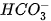
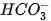 là base, H2O là acid. Trong phản ứng nghịch H2CO3 là acid, OH- là base.
là base, H2O là acid. Trong phản ứng nghịch H2CO3 là acid, OH- là base. lon 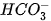 vừa có thể nhận H+, vừa có thể cho H+, vậy
vừa có thể nhận H+, vừa có thể cho H+, vậy 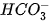 có tính chất lưỡng tính. Phân tử H2O cũng vừa có thể nhận H+, vừa có thể cho H+ nên H2O cũng là chất lưỡng tính.
có tính chất lưỡng tính. Phân tử H2O cũng vừa có thể nhận H+, vừa có thể cho H+ nên H2O cũng là chất lưỡng tính.
| CÂU HỎI VÀ BÀI TẬP 2. Dựa vào thuyết acid – base của Brønsted - Lowry, hãy xác định chất nào là acid, chất nào là base trong các phản ứng sau: a) CH3COOH + H2O b) S2- + H2O |
2. Ưu điểm của thuyết Brønsted - Lowry
Theo thuyết Arrhenius, trong phân tử acid phải có nguyên tử H, trong nước phân li ra ion H+, trong phân tử base phải có nhóm OH-, trong nước phân li ra ion OH-. Thuyết Arrhenius chỉ đúng cho trường hợp dung môi là nước. Thuyết acid – base của Brønsted - Lowry tổng quát hơn thuyết Arrhenius, phân tử không có nhóm OH như NH3 hoặc ion như 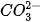 cũng là base.
cũng là base.
| EM CÓ BIẾT Thuyết acid-base của Brønsted - Lowry còn có thể mở rộng đối với những phản ứng acid - base trong dung môi không phải nước. Ví dụ, perchloric acid (HCIO4) trong dung môi acetic acid (CH3COOH), xảy ra phản ứng:
Trong phản ứng trên, HCIO4, là acid vì là chất cho H+, còn CH3COOH là base vì là chất nhận H+. |
III. KHÁI NIỆM PH VÀ Ý NGHĨA CỦA PH TRONG THỰC TIỄN
| EM CÓ BIẾT Tích số ion của nước (Kw)(1) Trong dung dịch nước, tích số Kw = [H+].[OH-] là một hằng số, chỉ phụ thuộc vào nhiệt độ và được gọi là tích số ion của nước. Ở 25 °C, Kw = 10-14, tuy nhiên giá trị này có thể được dùng khi nhiệt độ không khác nhiều với 25 °C. Đối với nước tinh khiết: [H+] = [OH-]= |
(1) Trong kí hiệu Kw w là viết tắt của từ tiếng Anh: water (nước).
(Trang 21)
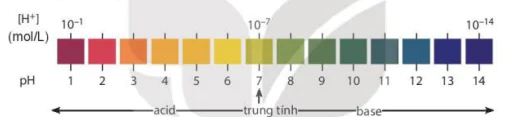
1. Khái niệm pH
Nồng độ ion H+ hoặc ion OH- được dùng để đánh giá tính acid hoặc tỉnh base của các dung dịch. Tuy nhiên, nếu các dung dịch có nồng độ H+, nồng độ OH- thấp, chúng là những số có số mũ âm hoặc có nhiều chữ số thập phân. Vì vậy, để tiện sử dụng, người ta dùng đại lượng pH với quy ước như sau:
pH = - Ig[H+] hoặc [H+] = 10-pH
Trong đó [H+] là nồng độ mol của ion H+.
Nếu dung dịch có [H+] = 10-ª mol/L thì pH = a.
Ví dụ: [H+] = 10-2 mol/L thì pH = 2.
Môi trường acid là môi trường có [H+] > [OH-] nên [H+] > 10-7 mol/L hay pH < 7.
Môi trường base là môi trường có [H+] < [OH-] nên [H+] < 10-7 mol/L hay pH > 7.
Môi trường trung tính là môi trường có [H+] = [OH-] = 10-7 mol/Lhay pH = 7.
Thang pH thường dùng có giá trị từ 1 đến 14.
| CÂU HỎI VÀ BÀI TẬP 3. Một loại dầu gội đầu có nồng độ ion OH- là là 10-5.17 mol/L. a) Tính nồng độ ion H+, pH của loại dầu gội nói trên. b) Môi trường của loại dầu gội đầu trên là acid, base hay trung tinh? 4. Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy pH đo được giá trị pH là 4,52. a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tinh. b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp đề giảm độ chua, tăng độ pH của đất. 5. pH của dung dịch nào sau đây có giá trị nhỏ nhất? A. Dung dịch HCI 0,1 M. B. Dung dịch CH3COOH 0,1 M. C. Dung dịch NaCl 0,1 M. D. Dung dịch NaOH 0,01 M. |
(Trang 22)
2. Ý nghĩa của pH trong thực tiễn
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ của con người, sự phát triển của động vật, thực vật,...
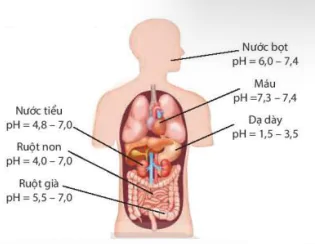
Hình 2.4. Chỉ số pH của các dịch trong cơ thể (1)
| EM CÓ BIẾT Chỉ số pH trong nước tiểu thường trong khoảng 4,8-7,0. Nếu pH nước tiểu cao trên 8,0, bệnh nhân có thể đang mắc một số bệnh như sỏi thận, nhiễm trùng đường tiết niệu,... Nếu pH nước tiểu thấp dưới 5,0, nước tiểu có tính acid hơn bình thường, bệnh nhân có thể đang mắc bệnh tiểu đường, tiêu chảy, mất nước,... |
Trong cơ thể của người, máu và các dịch của dạ dày, mật,... đều có giá trị pH trong một khoảng nhất định. Chỉ số pH trong cơ thể có liên quan đến tình trạng sức khoẻ. Nếu chỉ số pH tăng hoặc giảm đột ngột, không nằm trong giới hạn cho phép thì có thể là dấu hiệu ban đầu của bệnh lí, người bệnh cần được khám đề tìm ra nguyên nhân.
Một số động vật sống dưới nước cần môi trường có giá trị pH thích hợp, ví dụ: tôm và cá ưa sống trong môi trường nước có pH khoảng 7,5-8,5.
Một số loại thực vật chỉ phát triển tốt trong đất có giá trị pH thích hợp, ví dụ:

PH
Cây chè
4,5-5,5
Cây lúa
5,5-6,5
Cây cà chua
6,0-7,0
Trong đời sống hàng ngày, các sản phẩm như dầu gội, xà phòng, kem dưỡng da.... cũng đều cần có giá trị pH trong một khoảng nhất định đề an toàn cho người sử dụng.
| CÂU HỎI VÀ BÀI TẬP 6. Đo pH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng? A. Nước chanh có môi trường acid. B. Nồng độ ion [H+] của nước chanh là 10-24 mol/L. C. Nồng độ ion [H+] của nước chanh là 0,24 mol/L. D. Nồng độ của ion [OH-] của nước chanh nhỏ hơn 10-7 mol/L. 7. Nước Javel (chứa NaCIO và NaCl) được dùng làm chất tẩy rửa, khử trùng. Trong dung dịch, ion CIO- nhận proton của nước đề tạo thành HCIO. a) Viết phương trình hoá học của phản ứng xảy ra và xác định chất nào là acid, chất nào là base trong phản ứng trên. b) Dựa vào phản ứng, hãy cho biết môi trường của nước Javel là acid hay base. |
(1) Nguồn: Ý kiến chuyên gia về chuyển hóa thuốc và độc chất học.
(Trang 23)
4. Xác định pH
Giá trị pH của dung dịch được xác định gần đúng bằng cách sử dụng chất chỉ thị acid - base. Khi cần xác định giá trị pH chính xác hơn, người ta sử dụng máy đo pH. Chất chỉ thị acid – base là chất có màu sắc biến đổi phụ thuộc vào giá trị pH của dung dịch. Một số chất chỉ thị như giấy pH, giấy quỳ, phenolphthalein có màu sắc thay đồi trong các khoảng pH khác nhau (Bảng 2.1).
Bảng 2.1. Màu của giấy pH, giấy quỳ và phenolphthalein trong dung dịch ở các khoảng pH khác nhau
| Giấy quỳ | Đỏ pH ≤ 6 | Tím pH = 7 | Xanh pH ≥ 8 |
| Phenolphthlein | pH < 8 Không màu | pH > 8 Màu hồng | |
| Giấy pH |  | ||
| Hoạt động nghiên cứu Làm chất chỉ thị màu từ hoa đậu biếc/bắp cải tím Chuẩn bị: - Hoa đậu biếc (khoảng 50 g) hoặc bắp cải tím thái nhỏ (khoảng 100 g). - Cốc thuỷ tinh 250 mL, nước sôi, đũa thuỷ tinh, lưới vải lọc. - Các cốc (đã được dán nhãn) đựng giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối. - Giấy pH hoặc máy đo pH. Tiến hành: - Ngâm khoảng 50 g g hoa hoa đâu đậu biếc/100 biếc/100 g g bắp bắp cải cải tím tím đã đã được được c chuẩn bị vào 100 mL nước sôi trong khoảng 10 phút. Lọc bằng lưới lọc hoặc vải lọc, thu được dung dịch. Dung dịch này được sử dụng làm chất chỉ thị. - Dùng máy đo pH (hoặc giấy pH) xác định pH của các dung dịch. - Cho vài giọt chất chỉ thị lần lượt vào các dung dịch: giấm ăn, nước C sủi, nước rửa bát, nước soda, nước muối và khuấy đều. Quan sát sự đổi màu của các dung dịch. Hoàn thành thông tin theo mẫu bảng sau vào vở:
|
(Trang 24)
| EM CÓ BIẾT Chất chỉ thị màu trong tự nhiên Hoa đậu biếc, hoa cẩm tú cầu, hoa dâm bụt, bắp cải tím,... có chứa các hợp chất hữu cơ mang màu và màu sắc của chúng thay đổi theo pH của môi trường nên có thể sử dụng chúng làm chất chỉ thị màu. Ví dụ: sắc tố tạo màu đặc trưng cho đậu biếc là các hợp chất thuộc nhóm anthocyanin, một trong những chất chống oxi hoá tự nhiên. Ở môi trường pH nhỏ hơn 7 (môi trường acid), anthocyanin chuyển sang màu đỏ tím, ở môi trường pH lớn hơn 7 (môi trường base) chúng chuyển sang màu xanh sắm.
Hình 2.5. Một số loài thực vật có thể sử dụng làm chất chỉ thị màu Hoa đậu biếc Bắp cải tím Hoa dâm bụt Hoa cẩm tú cầu |
IV. SỰ THUỶ PHÂN CỦA CÁC ION
1. Môi trường của một số dung dịch muối
| Hoạt động nghiên cứu Cho các dung dịch sau: Na2CO3, AlCl3, FeCl3 1. Dùng giấy pH xác định giá trị pH gần đúng của các dung dịch trên. 2. Nhận xét và giải thích về môi trường của các dung dịch trên. |
Khi tan trong nước, muối phân li thành các ion. Phản ứng giữa ion với nước tạo ra các dung dịch có môi trường khác nhau được gọi là phản ứng thuỷ phân.
Ví dụ 1: Trong dung dịch Na2CO3, ion Na+ không bị thuỷ phân, còn 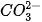 thuỷ phân trong nước tạo ion OH theo phương trình:
thuỷ phân trong nước tạo ion OH theo phương trình:
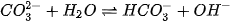
Vì vậy, dung dịch Na2CO3 có môi trường base. Na2CO3 được sử dụng trong công nghiệp thực phẩm, dệt, nhuộm, công nghiệp thuỷ tinh, silicate....
Ví dụ 2: Trong dung dịch AlCl3 và FeCl3, ion Cl- không bị thuỷ phân, các ion Al3+ và Fe3+ bị thuỷ phân trong nước tạo ion H+ theo phương trình ở dạng đơn giản như sau:
Al3+ + H2O + Al(OH)2+ + H+
Fe3+ + H2O  Fe(OH)2+ + H+
Fe(OH)2+ + H+
Do đó, dung dịch AlCl3, FeCl3 có môi trường acid. Trong thực tế, các loại đất có chứa nhiều ion Al3+, Fe3+ có giá trị pH thấp hay còn gọi là đất chua. Để khử chua, người ta bón vôi cho đất.
Các muối nhôm và sắt, ví dụ: phèn nhôm ((NH4)2SO4.Al2(SO4)3.24H2O) và phèn sắt ((NH4)2SO4 Fe2(SO4)3.24H2O) được sử dụng làm chất keo tụ trong quá trình xử li nước, dùng làm chất cầm màu trong công nghiệp dệt, nhuộm, hoặc làm chất kết dính, chống nhoè trong công nghiệp giấy,...
(Trang 25)
V. CHUẨN ĐỘ ACID-BASE
1. Nguyên tắc
Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ. Dựa vào thể tích của các dung dịch khi phản ứng vừa đủ với nhau, xác định được nồng độ dung dịch chất cần chuẩn độ.
Trong phòng thí nghiệm, nồng độ của dung dịch base mạnh (ví dụ NaOH) được xác định bằng một dung dịch acid mạnh (ví dụ HCI) đã biết trước nồng độ mol dựa trên phản ứng:
NaOH + HCI → NaCl + H2O
Khi các chất phản ứng vừa đủ với nhau, số mol HCI phản ứng bằng số mol NaOH.
Ta có:
VHCI • CHCI = VNaOH • CNaOH
Trong đó:
CHCI và CNaOH lần lượt là nồng độ mol của dung dịch HCI và dung dịch NaOH;
VHCI VÀ VNaOH lần lượt là thể tích của dung dịch HCl và dung dịch NaOH (cùng đơn vị đo).
Khi biết VHCI VNaOH trong quá trình chuẩn độ và biết CHCI sẽ tính được CNaOH.
Thời điểm để kết thúc chuẩn độ được xác định bằng sự đồi màu của chất chỉ thị phenolphthalein.
2. Thực hành chuẩn độ acid – base
Chuẩn bị:
- Dung dịch HCI 0,1 M; dung dịch NaOH nồng độ khoảng 0,1 M; dung dịch phenolphthalein.
- Pipette 10 mL; burette 25 mL; binh tam giác 100 mL; bình tia nước cất; giá đỡ, kẹp burret.
Tiến hành:
- Dùng pipette lấy 10 mL dung dung dịch dịch HCl 0,1 M cho cho vào vào bình bình tam giác, thêm 1 – 2 giọt phenolphthalein.
- Cho dung dịch NaOH vào burette, điều chỉnh dung dịch trong burette về mức 0.
- Mở khoá burette, nhỏ từng giọt dung dịch NaOH xuống bình tam giác (lắc đều trong quá trình chuẩn độ) đến khi dung dịch xuất hiện màu hồng nhạt (bền trong khoảng 10 giây) thì dừng chuẩn độ.
- Ghi lại thể tích dung dịch NaOH đã dùng.
Tiến hành chuẩn độ ít nhất ba lần, ghi số liệu thực nghiệm và hoàn thành vào vở theo mẫu bảng sau:
| VHCI (ML) | VNaOH (mL) | Vtb NaOH (mL) | CNaOH (mol/L) | |
| Thí nghiệm 1 | ? | ? | ? | ? |
| Thí nghiệm 2 | ? | ? | ||
| Thí nghiệm 3 | ? | ? |
(Trang 26)

Hình 2.6. Chuẩn độ dung dịch NaOH bằng dung dịch HCI

Hình 2.7. Thao tác khi chuẩn độ
Lưu ý:
- Tránh để các hoá chất như dung dịch HCI, dung dịch NaOH bắn vào tay, mắt.
- Các dụng cụ thuỷ tinh (bình tam giác, burette, pipette,...) dễ vỡ, cần cần thận.
| CÂU HỎI VÀ BÀI TẬP 8. Nêu một số điểm cần chú ý trong quá trình chuẩn độ. 9. Nêu một số nguyên nhân có thể dẫn đến sai số trong quá trình chuẩn độ. |
| EM ĐÃ HỌC
|
| EM CÓ THỂ
|

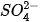 theo phương trình ion rút gọn:
theo phương trình ion rút gọn: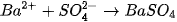
 CH3COO- + H3O+
CH3COO- + H3O+
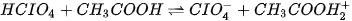
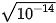 = 10-7 (mol/L).
= 10-7 (mol/L).







































































Bình Luận
Để Lại Bình Luận Của Bạn