Nội Dung Chính
(Trang 26)
I. HỆ THỐNG HOÁ KIẾN THỨC
1. Cân bằng hoá học
| Phản ứng một chiều aA + bB → cC + dD Phản ứng chỉ xảy ra một chiều từ chất đầu tạo thành sản phẩm. | Phản ứng thuận nghịch aA + bB → cC + dD Trong cùng điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau. |
| Trạng thái cân bằng | vthuận = vnghịch ; nồng độ các chất trong hệ phản ứng không đổi. |
| Hằng số cân bằng |
Trong đó: [A], [B], [C], [D] là nồng độ mol của các chất ở trạng thái cân bằng. Chất rắn không đưa vào biểu thức tỉnh Kc. Kc chỉ phụ thuộc vào bản chất của phản ứng và nhiệt độ. |
| Các yếu tố ảnh hưởng đến cân bằng hoá học | Nhiệt độ, nồng độ, áp suất. |
| Nguyên lí chuyển dịch cân bằng Le Chatelier | Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài như biến đổi nhiệt độ, nồng độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. |
2. Cân bằng trong dung dịch nước
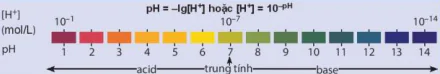
| Sự điện li Quá trình phân li các chất trong nước tạo thành ion. Chất điện li mạnh: acid mạnh, base mạnh, hầu hết muối. Chất điện li yếu: acid yếu, base yếu. Chất không điện li: nước, saccharose, ethanol,... | Thuyết acid - base của Bronsted - Lowry Acid là chất cho proton. Base là chất nhận proton. |
 | |
Trong dung dịch nước, một số ion như Al3+, Fe3+ và 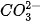 phản ứng với nước tạo ra các dung dịch có môi trường acid/base. phản ứng với nước tạo ra các dung dịch có môi trường acid/base. | |
(Trang 28)
II. LUYỆN TẬP
Câu 1. Hằng số Kc của một phản ứng phụ thuộc vào yếu tố nào sau đây?
A. Nồng độ.
B. Nhiệt độ.
C. Áp suất.
D. Chất xúc tác.
Câu 2. Thêm nước vào 10 mL dung dịch HCI 1,0 mol/L để được 1000 mL dung dịch A. Dung dịch mới thu được có pH thay đổi như thế nào so với dung dịch ban đầu?
A. pH giảm đi 2 đơn vị.
B. pH giảm đi 0,5 đơn vị.
C. pH tăng gấp đôi.
D. pH tăng 2 đơn vị.
Câu 3. Tính pH của các dung dịch sau:
a) Dung dịch NaOH 0,1 M;
b) Dung dịch HCI 0,1 M;
c) Dung dịch Ca(OH)2 0,01 M.
Câu 4. Viết biểu thức hằng số cân bằng Kỹ cho các phản ứng sau:
a) 2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
b) 2C(s) + O2(g)  2CO(g)
2CO(g)
c) AgCl(s) 
Câu 5. Cho cân bằng hoá học sau: H2(g) + I2(g)  2HI(g)
2HI(g) 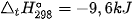
Nhận xét nào sau đây không đúng?
A. Khi tăng nhiệt độ, cân bằng trên chuyển dịch theo chiều nghịch.
B. Ở nhiệt độ không đồi, khi tăng áp suất thì cân bằng không bị chuyển dịch.
C. Ở nhiệt độ không đồi, khi tăng nồng độ H₂ hoặc 12 thì giá trị hằng số cân bằng tăng.
D. Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Câu 6. Xét phản ứng xảy ra trong lò luyện gang:
Fe2O3(s) + 3CO(g)  2Fe(s) + 3CO2(g)
2Fe(s) + 3CO2(g) 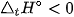
Nêu các yếu tố (nồng độ, nhiệt độ, áp suất) cần tác động vào cân bằng trên để cân bằng chuyển dịch về bên phải (làm tăng hiệu suất của phản ứng).
Câu 7. Cho cân bằng hoá học sau:
CO(g) + H2O(g) 
Ở 700 °C, hằng số cân bằng Kc = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín dung tích 10 lít và giữ ở 700 °C. Tính nồng độ các chất ở trạng thái cân bằng.
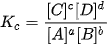









































































Bình Luận
Để Lại Bình Luận Của Bạn