Nội Dung Chính
(Trang 48)
Chuỗi xoắn kép DNA được tạo thành từ rất nhiều liên kết cộng hoá trị và liên kết hydrogen.
Các chất, dù là đơn chất hay hợp chất, thường tồn tại dưới dạng phân tử hoặc tinh thể. Phân tử do các nguyên tử kết hợp với nhau bằng liên kết hoá học: liên kết cộng hoá trị, liên kết ion. Giữa các phân tử còn có tương tác khác yếu hơn, như liên kết hydrogen, tương tác van der Waals.
| • Quy tắc octet • Liên kết ion • Liên kết cộng hoá trị • Liên kết hydrogen và tương tác van der Waals • Ôn tập |
(Trang 49)
MỤC TIÊU:
Trình bày và vận dụng được quy tắc octet trong quá trình hình thành liên kết hoá học cho các nguyên tố nhóm A.
| Khi các nguyên tử kết hợp với nhau tạo thành phân tử theo một tỉ lệ xác định, yếu tố nào quyết định tỉ lệ số nguyên tử của mỗi nguyên tố trong phân tử đó? |
I. KHÁI NIỆM LIÊN KẾT HOÁ HỌC
Theo thuyết cấu tạo hoá học, sự liên kết giữa các nguyên tử tạo thành phân tử hay tinh thể được giải thích bằng sự giảm năng lượng khi các nguyên tử kết hợp lại với nhau. Khi tạo liên kết hoá học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
Liên kết hoá học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Trong các phản ứng hoá học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết (electron hoá trị).
Các electron hoá trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
Bảng 10.1. Biểu diễn electron hoá trị của một số nguyên tử
| Nhóm | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA |
| Số electron hóa trị | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Biểu diễn nguyên tử với electron hóa trị | 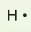 |  | ||||||
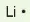 |  | 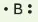 |  | 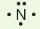 |  |  |  | |
 |  |  | 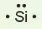 | 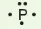 | 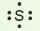 |  |  |
| 1. Khi nguyên tử fluorine nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào? 2. Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng nào? |
(Trang 50)
II. QUY TẮC OCTET
| Khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm (trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet. Khi hình thành liên kết hoá học trong phân tử Phân tử 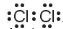 . Xung quanh mỗi nguyên tử chlorine đều có 8 electron. . Xung quanh mỗi nguyên tử chlorine đều có 8 electron. Khi hình thành liên kết hoá học trong phân tử | EM CÓ BIẾT Quy tắc octet chỉ đúng cho sự tạo thành liên kết hoá học giữa các nguyên tử của các nguyên tố thuộc chu kì 2 của bảng tuần hoàn và một số nguyên tử của các nguyên tố có tính kim loại, phi kim điển hình. Ngoài ra có các ngoại lệ. Ví dụ: Trong phân tử
|
Phân tử 
 . Xung quanh nguyên tử oxygen có 8 electron.
. Xung quanh nguyên tử oxygen có 8 electron. Khi hình thành liên kết hoá học trong phân tử NaF, nguyên tử Na có 1 electron hoá trị, nguyên tử F có 7 electron hoá trị, nguyên tử Na nhường 1 electron hoá trị tạo thành hạt mang điện tích dương, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích âm. Các hạt này đều đạt cấu hình electron bão hoà theo quy tắc octet và có điện tích trái dấu nên hút nhau.
| 3. Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: 4. Phosphine là hợp chất hoá học giữa phosphorus với hydrogen, có công thức hoá học là Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hoá học trong phosphine. |
| EM ĐÃ HỌC • Liên kết hoá học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn. • Quy tắc octet: Khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiểm. |
| EM CÓ THỂ Vận dụng quy tắc octet để giải thích sự hình thành liên kết hoá học trong một số phân tử của các nguyên tử nguyên tố nhóm A. |
 , nguyên tử chlorine có 7 electron hoá trị, mỗi nguyên tử chlorine cần thêm 1 electron để đạt cấu hình electron bão hoà theo quy tắc octet nên mỗi nguyên tử chlorine góp chung 1 electron.
, nguyên tử chlorine có 7 electron hoá trị, mỗi nguyên tử chlorine cần thêm 1 electron để đạt cấu hình electron bão hoà theo quy tắc octet nên mỗi nguyên tử chlorine góp chung 1 electron. , nguyên tử hydrogen có 1 electron hoá trị, nguyên tử oxygen có 6 electron hoá trị, mỗi nguyên tử hydrogen cần thêm 1 electron và nguyên tử oxygen cần thêm 2 electron để đạt cấu hình electron bão hoà theo quy tắc octet.
, nguyên tử hydrogen có 1 electron hoá trị, nguyên tử oxygen có 6 electron hoá trị, mỗi nguyên tử hydrogen cần thêm 1 electron và nguyên tử oxygen cần thêm 2 electron để đạt cấu hình electron bão hoà theo quy tắc octet.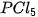 , lớp ngoài cùng của P có 10 electron.
, lớp ngoài cùng của P có 10 electron.
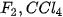 và
và 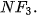 .
.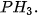 . Đây là chất khí không màu, có mùi tỏi, rất độc, không bền. Phosphine sinh ra khi phân huỷ xác động, thực vật và thường lẫn một lượng nhỏ diphosphine
. Đây là chất khí không màu, có mùi tỏi, rất độc, không bền. Phosphine sinh ra khi phân huỷ xác động, thực vật và thường lẫn một lượng nhỏ diphosphine 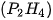






































































Bình Luận
Để Lại Bình Luận Của Bạn